Fester Blick, fester Händedruck, die Mundwinkel zucken nach oben. Jetzt könnte die Miene sich lösen, ein Lächeln vielleicht, doch da dreht sich Erik Gatenholm schon um und rennt los und bleibt nicht mehr stehen.
Gatenholm, groß, breit, glatt rasiert, läuft von einem verglasten Büro ins nächste, Sales-Team, Finance-Team, Schulterklopfen, Händeschütteln. Rennt die Treppe hinauf, in den Produktionsbereich, Menschen mit Schraubenziehern, Tische voller Platinen, Schulterklop- fen, Händeschütteln. Läuft die Treppe wieder hinunter, in sein Büro, das kleinste der Firma, ein enger Raum, offene Kartons und lose Zettel, der Schreibtisch brusthoch, davor ein Laufband und kein Stuhl.
Endlich bremst er, fällt in einen schwarzen Ledersessel, schiebt die Ellenbogen auf die Lehnen und sagt anschließend Sätze wie diesen: „Wenn du Erfolg als monetäre Kompensation begreifst, dann ist er leicht zu erreichen: Wenn du dir den Arsch abarbeitest, wirst du erfolgreich sein.“ Er arbeitet sich den Arsch ab, und er verdient Geld. Aber Erfolg, sagt er, sei für ihn etwas anderes.
Erfolg am Streckenrand
Gatenholm und sein Göteborger Start-up Cellink machen Geschäfte in einem Feld, das die Medizin revolutionieren könnte: Bioprinting, der 3D-Druck von menschlichem Gewebe – und eines Tages womöglich von menschlichen Organen . Es ist ein kompliziertes Feld. Ob die erste transplantierbare Leber in zehn oder 50 Jahren gedruckt wird, lässt sich nicht glaubwürdig vorhersagen. Sicher ist nur: Vor dem Profit stehen lange Jahre der Forschung. Das gilt für fast alle, die um die Wette laufen in diesem Rennen in die Zukunft.
Nur für den 28-jährigen Gatenholm gilt es nicht. Gatenholm rennt mit, aber er hat es nicht auf die Siegprämie abgesehen. Er macht sein Geld am Streckenrand. Gatenholm verkauft vergleichsweise günstige 3D-Bioprinter, mit denen immer mehr Labore arbeiten. Vor allem aber verkauft er: die Tinte.
Es sind große Hoffnungen, die sich mit Bioprinting verknüpfen. Erfüllt die Technologie diese Hoffnungen, wird sich vieles ändern. In den Krankenhäusern und Pharmalaboren dieser Welt ebenso wie im Leben zahlloser Patienten.
Tests an gedrucktem Gewebe könnten viele Tierversuche ersetzen. Mithilfe von nachgedruckten Tumoren ließe sich für jeden Krebspatienten das passende Medikament finden. Und sobald Niere, Leber oder Herz aus dem 3D-Drucker kommen, werden sie Leben retten. Denn statistisch gesehen sterben in Deutschland jeden Tag drei Menschen, weil sie kein passendes Spenderorgan erhalten.
Der Bioprinter seines Vaters
Für das Jahr 2024 schätzt der kalifornische Marktforscher Grand View Research den globalen Markt für Bioprinting auf ein Volumen von 2,6 Mrd. Euro. Pro Jahr wachse er bis dahin um knapp ein Fünftel. Noch steckt Bioprinting in den Laboren, aber das Potenzial ist groß.
Das erkannte Gatenholm vor etwa vier Jahren, kurz vor Abschluss seines MBAs in Göeborg. Die Welt der Zellen und Labore war ihm nie fremd gewesen, sein Vater war Biologie-Professor. Damals, im Frühjahr 2015, bestellte der Vater einen Bioprinter für seine Fakultät in Goteborg. Er zeigte das Gerät seinem Sohn, und Erik, auf der Suche nach einer Geschäftsidee, sah darin seine Chance.
Gedruckte Organe, eine Revolution der Medizin – die Vision überzeugte ihn. Er wollte die Technologie besser verstehen, ein wenig herumexperimentieren. Dafür brauchte er Tinte. Was in diesem Fall heißt: eine Art Nährlösung, die nur noch mit den passenden Zellen aus Knochen, Haut oder anderen Organen versetzt werden muss; flüssig genug, um durch einen Druckkopf zu fließen, aber fest genug, um danach eine Form zu halten; ein bioaktives Gel – das es aber nirgendwo zu kaufen gab.
Start mit „Bioinks"
Bioprinter standen schon damals in Laboren auf der ganzen Welt, doch meist musste man die Tinte dort noch selbst mischen. Da war sie, die Lücke, die Gatenholm gesucht hatte. Gatenholm stellte ein vierköpfiges Team zusammen:
Ein Bekannter, promoviert und Spezialist für Gewebetechnologie, kümmerte sich um das Wissenschaftliche, er selbst um das Geschäftliche. Anfang 2016 ging Cellink mit einer der weltweit ersten standardisierten „Bioinks“ an den Markt. Eine Lösung, verwendbar in fast jedem Bioprinter. „Es hat einfach Sinn ergeben“, sagt Gatenholm in seinem Ledersessel. „Es gab die Drucker, aber keine Tinte.“
Heute hat das Unternehmen etwa 75 fest angestellte Mitarbeiter und beliefert mehr als 400 Kunden in knapp 50 Ländern, darunter die Harvard University und das MIT. Im Vergleich zum Vorjahr hat sich der Umsatz zwischen Herbst 2017 und Herbst 2018 mehr als verdreifacht auf umgerechnet fast 4,2 Mio. Euro – der Gewinn ist noch schmal, aber das Unternehmen bereits profitabel.
Gegen die Sterblichkeit
Dieser Erfolg erzählt von mehr als Unternehmerehrgeiz, er erzählt von der Sehnsucht, den Tod hinauszuzogern – denn das ist es, was Bioprinting letztlich verspricht: Wer Organe per Knopfdruck herstellen kann, geht mit breiter Brust in den Kampf gegen Krankheiten und die eigene Sterblichkeit.
„Dass Bioprinting die Dinge dramatisch revolutionieren könnte, ist gar keine Frage“, sagt Christian Foltz, Partner bei Strategy& Deutschland, der Strategieberatungsfirma von PwC. Doch müsse man genau trennen zwischen Wirklichkeit und Hype. Gewebe lasse sich zwar schon heute teilweise drucken, aber noch nicht transplantieren.
Das kalifornische Unternehmen Organovo etwa arbeitet an hautähnlichem Gewebe für kosmetische Tests und kooperiert unter anderem mit dem Kosmetikkonzern L’Oréal. Auch das französische Start-up Poietis hat ein solches Hautmodell entwickelt und arbeitet mit dem Chemiekonzern BASF zusammen.
Neben Poietis und Organovo forschten auch viele andere Gruppen an gedruckter Haut, sagt Michael Gelinsky von der TU Dresden. Gelinsky beschäftigt sich seit vielen Jahren mit dem Thema und sitzt im Editorial Board der Wissenschaftszeitschrift „ Journal of 3D Printing in Medicine “. Von allen Bioprinting- Anwendungen würden Hautmodelle als Erste die Marktreife erreichen, glaubt Gelinsky. Vermutlich schon in wenigen Jahren.
3D-Gewebe vorerst für die Forschung entwickelt
Für Patienten aber wird sich dadurch noch nicht viel ändern. Denn das meiste Gewebe aus dem 3D-Drucker, betont Gelinsky, werde zunächst für die Forschung entwickelt, für Pharma- und Kosmetiktests – und nicht für den Einsatz im Krankenhaus. Das gelte auch für die Hautmodelle.
„Haut ist deutlich mehr als das, was da gedruckt wird“, sagt Gelinsky. „Schweißdrüsen, Talgdrüsen, Nerven, Blutgefäße, Haarzellen, Pigmentzellen: All das fehlt noch.“ Um die Verträglichkeit von Salben oder Cremes zu testen, genügten die Modelle zwar. Eine voll funktionsfähige, gedruckte Haut aber liege noch in weiter Ferne – und erst recht ein voll funktionsfähiges inneres Organ.
Es ist ein Zukunftsgeschäft, das einen langen Atem erfordert. Das zeigt sich auch in den Bilanzen. Das 2007 gegründete Unternehmen Organovo, ebenfalls börsennotiert, macht nach wie vor Verlust. Der Weg sei lang und mühsam, sagt Strategieberater Foltz. Niemand könne seriös prognostizieren, wann der menschliche Ersatzteilkasten aus dem 3D- Drucker Wirklichkeit wird.
Profit in den Kartuschen
Gatenholm kümmert das nicht. Er sagt: „Wir ölen den Wettbewerb.“ Kurz nachdem Cellink die ersten Tinten auf den Markt gebracht hatte, entwickelte es seinen ersten eigenen Bioprinter. Die Geräte der Konkurrenz kosteten damals weit mehr als 100 000 Euro, sagt Gatenholm. Cellink bot seinen Inkredible-Drucker für weniger als 10 000 Euro an, verkaufte ihn in alle Welt und schuf sich Kunden für seine Tinten.
Es ist wie bei Papierdruckern: Der Profit steckt in den Kartuschen, nicht im Gerät. Den meisten Umsatz macht Cellink derzeit noch mit seinen mittlerweile drei Bioprinter-Modellen: Rund fünf Geräte verkaufen sie pro Woche – doch der Tintenbereich wächst rasant.
Inzwischen bietet Cellink etwa 30 verschiedene Gemische an. Sie alle fördern das Wachstum ganz bestimmter Zellen, etwa Knorpel oder Haut. Die Tinten, sagt Gatenholm, werfen eine Marge von 75 bis 85 Prozent ab.
Börsenstart nach zehn Monaten
Cellinks Investoren erkannten schnell das Potenzial. Bereits zehn Monate nach der Gründung ging Cellink an die Börse. Wenige Stunden nachdem das Unternehmen im Nasdaq North gelistet war, hatte sich der Preis der Aktie bereits verdoppelt.
Bei Investoren abseits der Börse sammelte Gatenholm im vergangenen Geschäftsjahr rund 13 Mio. Euro ein, 11 Mio. davon bei Banken und Pensionsfonds. Auch die EU fördert Cellink. Zum Vergleich: Das franzosische Start-up Poietis , das mit BASF kooperiert, hat rund 7,5 Mio. Euro Investorengelder eingesammelt, seit es 2014 gegründet wurde.
Immer mehr Labore auf der ganzen Welt experimentieren mit Bioprinting, und die Drucker und Tinten von Cellink erleichtern ihnen das. Gatenholm beliefert Unternehmen aus der Pharma-, Biotech- und Medizintechnikbranche, vor allem aber hat er es auf Hochschulen und Universitäten abgesehen. „Weltweit gibt es 27 000“, sagt er. „11 000 davon sind potenzielle Kunden.“
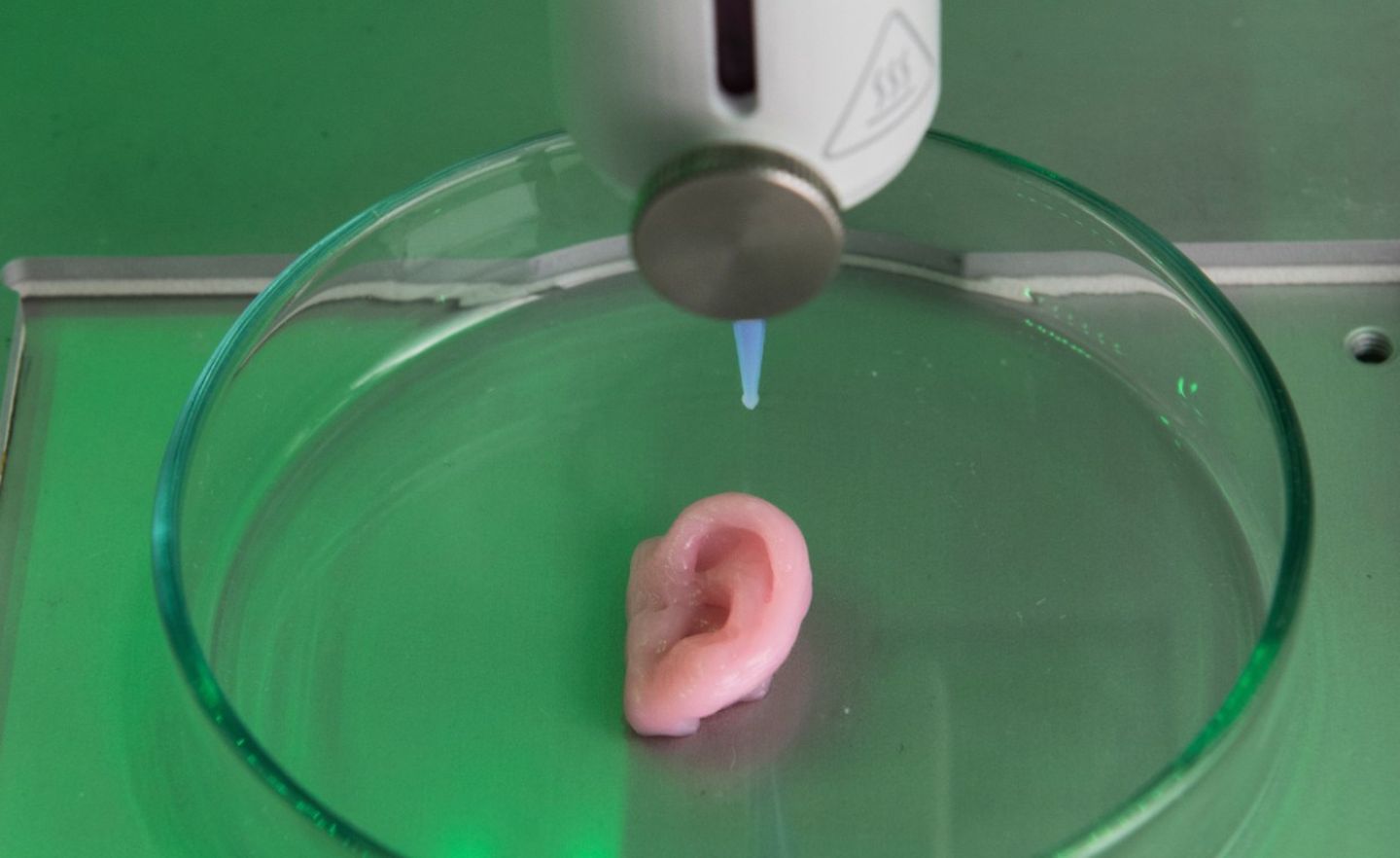
Wie es aussieht, wenn ein Labor mit Bioprinting experimentiert, lässt sich ein Stockwerk über Gatenholms Büro besichtigen. In einem Raum mit viel Edelstahl und schwarz-gelben Warnhinweisen an den Schranktüren steht ein Bio-X-Drucker von Cellink, ein weißer Würfel, etwa 50 Zentimeter hoch.
Er arbeitet an einem Aortenbogen, einem Teil der Hauptschlagader nahe dem Herz. Das 3D-Druckmodell des Aortenbogens stammt von einem USB-Stick, den Rest haben die beiden Mitarbeiter in den weißen Mänteln per Touchscreen eingetippt: Druck, Geschwindigkeit, Temperatur. Der Bio X surrt.
Übung für Chirurgen
Hinter bläulichem Plexiglas fahren die drei Druckköpfe hin und her, senken und heben sich, bleiben wenige Millimeter über einer Petrischale stehen, bewegen sich mit präziser Gleichmäßigkeit, drücken Biotinte aus ihren Düsen, und langsam, Schicht für Schicht, wächst etwas heran. Nach rund einer Stunde ist das Modell fertig. Die Männer gießen eine chemische Lösung darüber, die Tinte erstarrt, und was da nun in der Petrischale steht, sieht aus wie ein Aortenbogen.
Nur ist es keiner. Die Männer testen bloß, wie gut sich die Tinte drucken läst, sie ist nicht mit menschlichen Zellen versetzt. Wäre sie es, käme der gedruckte Aortenbogen nun in einen Inkubator, 37 Grad Celsius, Körpertemperatur, die Zellen würden wachsen, und irgendwann würde das Gebilde zu Gewebe werden, mit vielen der Eigenschaften eines Aortenbogens. Aber eben nicht mit allen. Er könnte etwa Chirurgen zur Übung dienen – transplantiert werden könnte er nicht.
Dem Aortenbogen fehlt das, was jedem bislang gedruckten Gewebe gefehlt hat: das Gefäßsystem, diese vielen Tausend Äderchen, winzig und verästelt. „Dieses funktionale Gefäßsystem werden wir nicht drucken können“, sagt Gelinsky. „Da müssen wir andere Lösungen finden.“ Aber genau die hat bisher noch niemand entdeckt.
Das gilt auch für die israelischen Forscher, die Mitte April verkündeten, das erste Herz aus menschlichem Gewebe gedruckt zu haben – ein sehr kleines zwar und noch lange nicht transplantierbar, aber eben mit Blutgefäßen.
Behörden tun sich schwer bei Zulassungen
Gelinsky will nicht schlechtreden, was die Forscher erreicht haben, stellt aber klar: Auch in diesem Fall wurden keine Kapillargefäße gedruckt – und ohne diese kleinsten aller Blutgefäße könne das Ganze einfach nicht funktionieren.
Und auf dem Weg zu transplantierbaren Geweben oder gar Organen aus dem 3D-Drucker ist das nur ein Problem, wenn auch eins der größten. Gelinsky erinnert an die Erfah- rungen aus dem Tissue Engineering, wo Gewebe mit klassischen Methoden im Labor gezüchtet wird. Seit den 80er-Jahren forschen Wissenschaftler in dem Bereich, sie haben einiges erreicht. Aber kaum etwas davon sei bei den Patienten angekommen, sagt Gelinsky.
Die Herstellung solcher Gewebe sei nach wie vor teuer – und die Zulassungen fehlten. „Die Behörden in Europa und in den USA tun sich bis heute schwer damit, den Einsatz solcher zellhaltigen Konstrukte zu genehmigen.“ Im Laufe der vielen Arbeitsschritte, so die Sorge, könnten die Zellen umprogrammiert werden und irgendwann einen Tumor bilden.
Bioprinting könnte die Automatisierung und Standardisierung zwar erleichtern und damit Fehlerquellen verringern – aber Gelinsky bezweifelt, dass den Zulassungsbehörden das genügt.
Die Pharma- und Kosmetikindustrie werden trotzdem von Bioprinting profitieren, sie werden ihre Produkte effizienter testen können. Ein Test an dreidimensional gedrucktem Gewebe liefert mehr Erkenntnisse als ein Test an ein paar menschlichen Zellen in der Petrischale – und könnte manch einen Versuch an Mäusen überflüssig machen.
Auch Krebspatienten wird die Technologie helfen. Derzeit kann es dauern, das Medikament zu finden, das am besten wirkt und am meisten schont. Künftig, vermutlich schon innerhalb der nächsten zehn Jahre, werden Ärzte vorab testen können, wie die Wirkstoffe anschlagen: an einem individuell nachgedruckten Tumor.
Geld kommt, Geld geht
Ein langes Rennen aber liegt vor denen, die als Erste transplantierbare Organe drucken wollen. Fragt man Gatenholm, dann rennen sie in die richtige Richtung. Ohne Lachen, ohne Anflug von Ironie spricht er in seinem Ledersessel von „der Wissenschaft, mit der wir die Welt verändern“. Jeder, sagt er, solle diese Technologie nutzen können.
Er will die Branche demokratisieren, um das Leben zu revolutionieren. Natürlich will er Geld verdienen, aber er will auch, dass man sich an ihn erinnert. Das, sagt er, ist für ihn Erfolg.
Dafür rennt Gatenholm von Meeting zu Meeting, arbeitet 16 Stunden am Tag und schläft den Rest. „Wenn in 40 Jahren jemand meint: ‚Erik war fundamental für unsere Forschung‘, dann wird das Generationen überdauern.“ Die Mundwinkel bleiben unten, der Blick fest. „Geld kommt, Geld geht. Vermächtnisse bleiben.“
Dann muss Erik Gatenholm los, nach oben in den Produktionsbereich, auch der Chef schraubt hier Drucker zusammen. „Wir sind noch zu klein“, sagt er und springt aus dem schwarzen Ledersessel. Dann dreht er sich um. Und rennt los.
Der Beitrag ist in Capital 06/2019 erschienen. Interesse an Capital? Hier geht es zum Abo-Shop , wo Sie die Print-Ausgabe bestellen können. Unsere Digital-Ausgabe gibt es bei iTunes und GooglePlay